芍药休眠芽发育进程内源激素变化研究
植物花芽的发育与内源激素关系密切。以芍药品种大富贵休眠期花芽为材料,采用高效液相色谱技术( HPLC) 分析内源激素 GA3,IAA,ZT,ABA 在芍药休眠芽发育不同时期的含量变化。结果表明: ABA 含量在北京地区 11 月 20 日开始增加,12 月 10 日达到最大; GA3含量 12 月 10 日开始明显上升,12 月 30 日开始下降; ZT 与 GA3含量变化基本一致; IAA 在休眠过程中含量很低且变化不大; GA3/ ABA 和 ZT / ABA 的比值随休眠的加深而减小,随休眠的解除而增大。研究证明 GA3和 ZT 是解除休眠的促进物,这一结果对于施用外源激素打破芍药休眠具有理论指导意义。
在长期的系统演化过程中,芍药形成了冬季低温休眠的特性,其种子和芽均须经过一定的低温过程才能破除休眠而萌发,这种休眠表现为秋季先产生根系,经历一段寒冷低温时期打破上胚轴和芽休眠后再出土萌发。在北京地区,芍药休眠芽的发育进程是 10 月底至 11 月初地上部分枯死,根茎上着生的混合芽在土壤内越冬,次年春天再萌芽生长。要实现芍药的商业生产可以利用冷藏和赤霉素处理解除芍药花芽休眠,再转入适宜生长的条件下培养一定时间,即可诱导芍药春节前后开花。研究表明,植物休眠由内源激素控制,休眠的起始、终止和调控以及休眠各阶段的变化均受激素调节,而且不是单一激素调节,而是由多种激素之间的平衡所控制,涉及芽休眠的激素有脱落酸( ABA) 、赤霉素( GA3) 、细胞分裂素( ZT)和生长素( IAA) 。以往的研究多集中在植物激素与木本植物芽休眠的关系上,如杨树、杉木等。对芍药科木本植物牡丹花芽的研究显示,低温期内 GA3,ABA,CTK 质量分数的增减和 GA3/ ABA 比值的变化可明显地反映低温解除花芽休眠的进程。其中,GA3/ ABA 比 值的变化与休眠的进程直接对应,并证明了 GA3和CTK 是解除休眠的促进物,ABA 是解除休眠的抑制物。Mornya 等指出,牡丹在秋季花芽分化期IAA 和 GA3的含量增加,ABA 的含量减少,从而诱导开花。牡丹秋季二次开花可以通过调节 GA3,IAA 和 CTK 的含量来实现,但对于宿根花卉芍药的内源激素研究还是空白。
本研究采用高效液相色谱技术( HPLC) ,分别测定了芍药芽休眠进程中赤霉素( GA3) 、生长素( IAA) 、细胞分裂素( ZT) 、脱落酸( ABA) 含量及其比值的动态变化,探讨了内源激素在低温打破休眠中的调节作用,这对于芍药反季节催花时外源激素的施用,具有一定的指导意义。
1 材料与方法1. 1 材料2009 年 10 月 21 日至 2010 年 3 月选取生长健壮、4 年生大富贵芍药品种进行花芽采集,每隔10 d 取一次芽,剥除外层鳞片,液氮处理材料后进行超低温保存,用于 GA3,IAA,ZT,ABA 浓度含量测定,取样标准为纵径 × 横径≥1. 5 cm × 0. 5cm 的顶芽,每处理每次取样 8 ~ 10 个芽。1. 2 方法全部取样完成后,采用液相色谱分析法测定各类激素的浓度。称取上述材料各 0. 5 g,放入冰研钵内,加入少量铜试剂( 抗氧化剂) 和少量( 10 m L) 80% 冷甲醇,低温研磨成匀浆,4℃ 浸泡过夜。次日取出样品并加入适量 PVP( 非水溶性聚乙烯吡咯烷酮) ,放于摇床上 10 min,再将匀浆在室温下抽滤,残渣以 80% 冷甲醇冲洗 3 ~ 4 次,抽滤后合并提取液。给提取液加 1 ~ 2 滴氨水,35 ~ 40℃ 减压浓缩至水相,用蒸馏水转移入 10m L 离心管中,在 6 000 r·min- 1下离心 20 min,弃残渣,将上清液均匀分成两份。一份用 1 mol·L- 1的 HCl 调至 p H 2. 5 ~ 3. 0,用等体积乙酸乙酯萃取 3 次,合并有机相,加 1 ~ 2 滴氨水,35 ~ 40℃浓缩至干,然后用 3% 色谱甲醇与 97% 0. 1 mol·L- 1HAc 的混合溶液溶解浓缩干的物质并定容至1 m L,用 0. 45 μL 微膜过滤,用于测定 IAA,GA3,ABA 的含量。另一份用 1 mol·L- 1的氨水调至p H 7. 5 ~ 8. 0,用等体积 p H 8. 0 磷酸缓冲液饱和的正丁醇萃取 3 次,合并有机相,60℃ 浓缩至干,然后用 3% 色谱甲醇与 97% p H 7. 0 超纯水的混合溶液溶解浓缩 干的物质 并定容至 1 m L,用0. 45 μL 微膜过滤,用于测定 ZT 的含量。采用高效液相色谱( HPLC) 法,色谱条件:Agilent 1100 高效液相色谱仪,C18柱( 250 × 4. 6mm) ,二极管阵列检测器,四元泵,自动进样器,柱温箱 30℃,在线脱气机,流动相分别为: 测定IAA,GA3,ABA 采用 3% 色谱甲醇与 97% 0. 1mol·L- 1HAc 的混合溶液,测定 ZT 采用 3% 色谱甲醇与 97% p H 7. 0 超纯水的混合溶液,检测波长分别为: IAA—280 nm,ABA—260 nm,GA3—210 nm,ZT—267 nm,流速为 1 m L·min- 1,外标法定量,标样均为 Sigma 产品。
2 结果与分析2. 1 芍药休眠芽内源激素含量动态变化2. 1. 1 生长素( IAA) 含量随时间的变化花芽休眠阶段生长素含量很低,总体变化幅度不大。
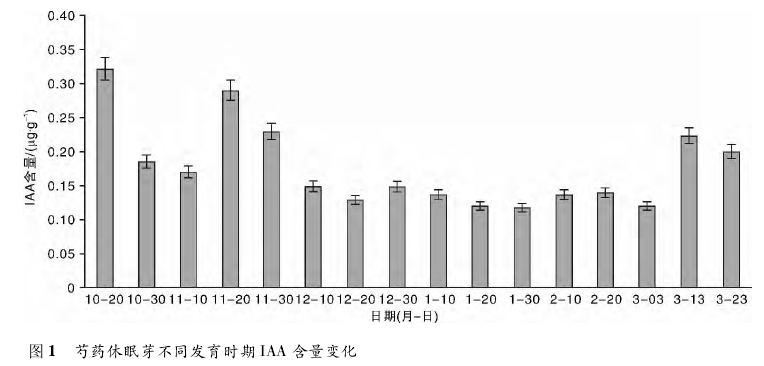
从图 1 中可以看出,10 月 20 日至 11 月10 日花芽 IAA 含量下降,此时芍药已基本停止生长; 随后 IAA 的含量开始增加,11 月 20 日达到顶峰。经分析,其产生的原因可能是休眠芽聚集能量,以抵御寒冷的气候和为幼芽提供过冬的营养物质。此后,IAA 含量开始大幅下降,12 月 20 日至 3 月 3 日均处于较低水平。直到 3 月 13 日,IAA 含量大幅上升,此时芍药开始萌发。由此可以得出,IAA 含量在休眠期内的变化呈现先下降后上升再下降,然后一直处于较低浓度水平上的规律,虽然 IAA 含量最后在休眠解除期有明显增加,但并不能就此确定 IAA 直接参与休眠的解除,在解除休眠中可能无明显的作用,而作用于花芽解除休眠后的萌发生长,更确切的结论有待进一步验证。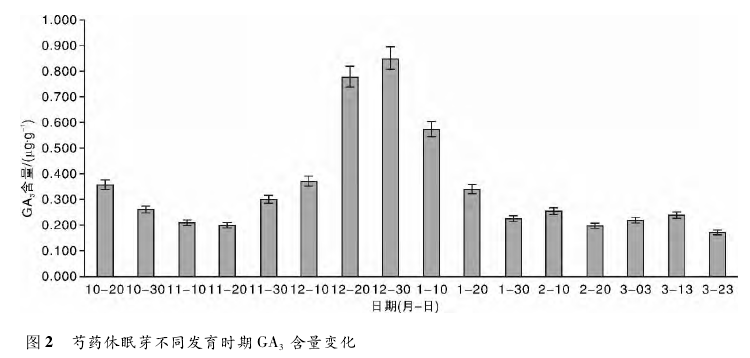
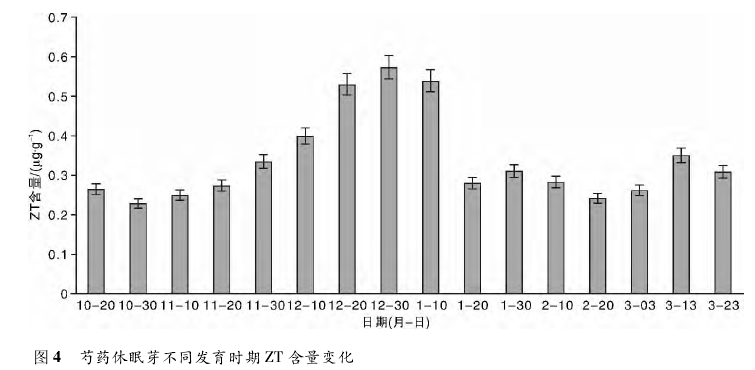
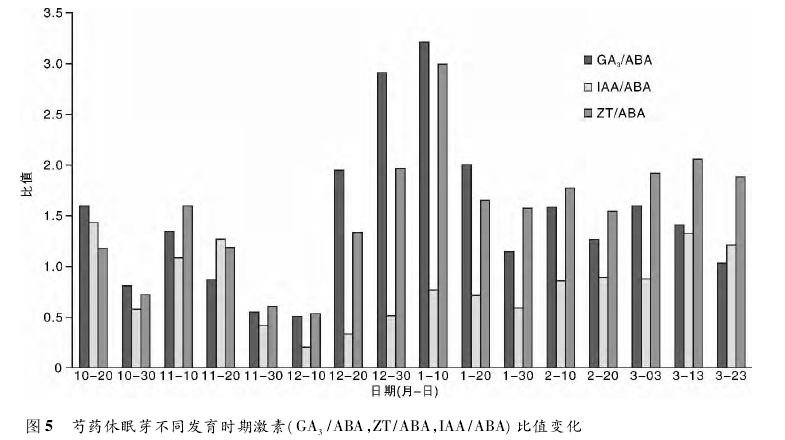
 含量变化趋势一致,与 ABA 含量变化趋势正好相反。ZT 含量 12 月 30 日开始下降,3 月 13 日随着休眠的解除有所上升,此时,细胞分裂素可能促进细胞分裂和扩大,诱导花芽的分化。因此,ZT 能够克服萌发抑制的因子,解除休眠,促进花芽的萌发。2. 2 芍药休眠芽中内源激素比值的变化根据前人对树木的研究发现,内源激素的比值对植物休眠状态的影响极为重要。本试验也发现休眠芽内源激素比值变化比单一激素更能反映芍药花芽的休眠进程。
含量变化趋势一致,与 ABA 含量变化趋势正好相反。ZT 含量 12 月 30 日开始下降,3 月 13 日随着休眠的解除有所上升,此时,细胞分裂素可能促进细胞分裂和扩大,诱导花芽的分化。因此,ZT 能够克服萌发抑制的因子,解除休眠,促进花芽的萌发。2. 2 芍药休眠芽中内源激素比值的变化根据前人对树木的研究发现,内源激素的比值对植物休眠状态的影响极为重要。本试验也发现休眠芽内源激素比值变化比单一激素更能反映芍药花芽的休眠进程。
图 5 中可以看出,休眠芽中 IAA/ABA 的比值在整个过程中基本上没有变化,而 GA3/ ABA,ZT / ABA 的比值变化趋势大体相同。随着花芽的休眠与解除,GA3/ ABA和 ZT/ABA 的比值基本呈现先下降后急剧上升再下降的趋势,到 1 月 30 日下降到一定水平后基本平稳,并与 11 月 20 日之前基本持平。由此可以认为 GA3,CTK 和 ABA 均参与了这一期间的调控活动,三者的消长关系控制着芍药植株花芽的休眠和解除休眠的进程。
3 讨论芍药植株进入休眠后,必须接受一个低温量值才能打破休眠,低温解除休眠的程度与抑制物的消失、促进物的出现以及促进物/抑制物比值的变化有关。研究发现,IAA 的含量变化与芍药花芽的发育过程相一致。当芍药基本停止生长的时候,IAA 的含量开始下降; 随着花芽进入休眠,IAA 含量开始上升。经分析,原因可能是休眠芽聚集能量,以抵御寒冷的气候和为幼芽提供过冬的营养物质。此后,IAA 含量开始大幅下降,并处于较低浓度的水平上,可以分析得出IAA 可能并未直接参与休眠的解除。直到花芽开始萌发,IAA 含量再一次上升,推断出 IAA 的作用在于花芽解除休眠后的萌发生长。经过初步分析,IAA 一般和营养积累有关,IAA 含量的增加是因为营养需求的增加,反之亦然。随着低温期的延长,花芽内 GA3含量呈现先缓慢下降后大幅上升再大幅下降的趋势,可见GA3含量变化对于休眠解除有明显的调节作用。可以推测得出,低温过程促进了 GA3的合成,当内源 GA3达到一定的阈值之后,休眠的解除开始启动,从而增强了与休眠解除相关基因的表达,最终导致了休眠解除。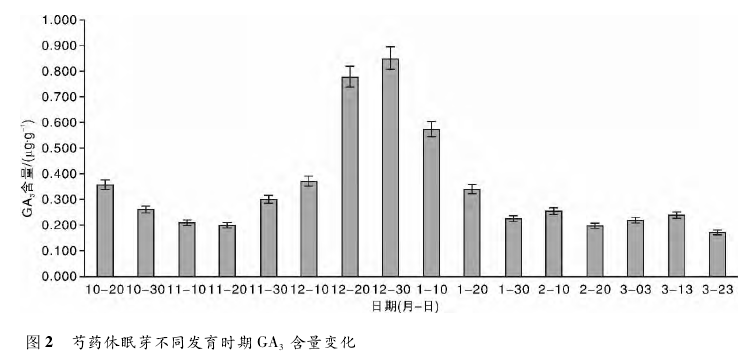
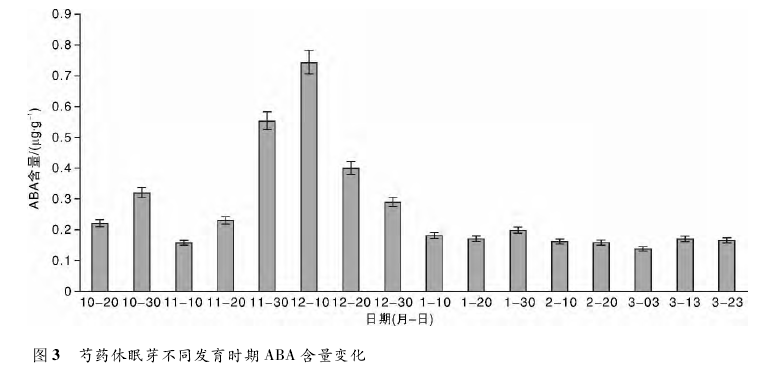
这一结论验证了生产上通过施用外源激素促进植株解除休眠、促进花芽分化,从而达到提早开花目的的可行性。GA3对花芽的形成存在抑制或根本不起作用的观点不一致,原因很可能是研究的植物种类存在差异,芍药存在低温休眠的特性,并且其花芽属于花叶混合芽,开放时既开花又抽枝展叶,因此这种混合芽的特殊休眠机理很可能影响 GA3的作用机制。在芍药休眠过程中,ABA 含量变化呈明显的倒 V 形。随着芍药深休眠期的来临,ABA 含量大幅增加,由此推断 ABA 可以提高植株的抗逆性,增强对寒冷环境的抵御能力。随着休眠的逐渐解除,ABA 含量开始下降,并趋于平稳。由此可见,ABA 含量的下降有利于芍药休眠的解除和花芽的萌发,验证了 ABA 是花芽萌发的抑制物质。花芽的休眠,显然与内源 ABA 的含量变化有关。从而可以得出结论,休眠芽的形成,有赖于秋季ABA 的积累; 休眠的解除,可能取决于入冬后ABA 含量的下降,ABA 主要起促进作用,推测其不一致的原因可能与研究的环境条件和植物种类的不同有关。试验表明,ZT 含量随着休眠程度的加深而增加,由此推测 ZT 在这个过程中加快了细胞分裂分化的速度,加厚角质层,提高对叶原基的保护能力。随着休眠的逐渐解除,ZT 的含量下降到一定水平后趋于平稳,此时,细胞分裂素可能促进细胞分裂和扩大,诱导花芽的分化。从而得出结论,ZT 能够克服萌发抑制的因子,解除休眠,促进花芽的萌发。不难发现,ZT 与 GA3含量在休眠过程中变化趋势基本一致,与 ABA 含量变化趋势正好相反。通常认为,芽的休眠由内源激素控制,休眠的起始、终止和调控以及休眠阶段的改变受激素调节,环境因素( 外部信号) 也通过影响激素( 内部信号) 的合成与运输来影响休眠进而改变低温需求量。但是,至今对于激素调控花芽休眠的机理仍只停留在猜测阶段,缺乏更为有效的试验手段。
本试验也只是通过研究内源激素的动态变化来分析其与花芽休眠的关系,外部环境因素的综合影响还有待进一步研究。解除芍药休眠是芍药促成栽培成功的 关键。通过本试验发现,ABA 是芍药休眠的促进物,而 GA3和 ZT 有利于芍药休眠的解除,IAA在植物进入休眠前起到提供能量的作用,并在休眠结束后促进花芽的生长、分化。芍药的休眠进程取决于多种激素的平衡关系,而不是单一激素的含量多少。所以,笔者认为芍药促成栽培的研究不应仅仅局限于通过施用外源 GA3解除芍药休眠,而应充分利用其他植物激素,同时重视对外部环境因素综合而深入的研究,寻求打破芍药休眠的有效方法,从而促进芍药的周年商业生产。
